Paraffin Section
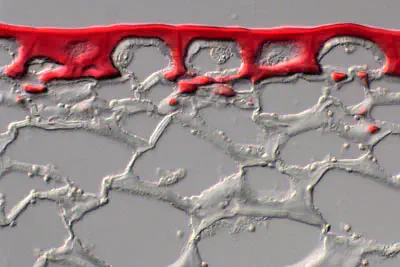 From phys.org
From phys.org一、固定
取新鲜的植株材料,用 ddH2O 清洗干净,放入FAA 固定液(100 mlFAA:5 ml福尔马林(5%)+5 ml冰醋酸(5%)+90 ml 70%或者50%的ethanol溶液(63%或45%),固定过夜(8 h以上)。若样品漂浮在固定液表面,则抽真空,每次10 min,反复3~4 次,直至材料沉没在固定液中。抽真空后更换一次新鮮的固定液。
二、脱水
用 70%的乙醇溶液将固定好的植物材料清洗3-4次,除去残留在組织内的固定液及其结晶沉淀。为避免材料的急剧收缩,按以下顺序对材料进行乙醇浓度梯度逐级脱水:70%——85%——95%——100%——100%,每步至少1 h。
三、透明化
以二甲苯作为透明剂,替换出植物组织体内的乙醇。按以下顺序对材料进行逐级透明化:无水乙醇/二甲苯(1:1)——二甲苯——二甲苯,每步至少1.5 h,可根据组织大小适当延长透明时间,直至组织完全透明。
四、浸蜡
用石蜡取代透明剂 ,使石蜡浸入植物组织内。按以下顺序对材料进行浸蜡:二甲苯/石蜡(1:1)——石蜡——石蜡,其中二甲苯/石蜡(1:1)一步可过夜(8 h以上),每次纯石蜡浸渍至少3 h。
五、包埋
将已融化的纯石蜡倾倒入准备好的锡纸模具中,用加热过的镊子将材料放入模具中,使其完全浸没于石蜡中,冷却后,放入4°C冰箱中备用。
六、切片、展片
- 将包埋有材料的蜡块固定在石蜡切片机(Leica,Modell RM2135)上,用刀片将蜡块修成梯形,在果皮材料周围各留约2mm。切片的厚度为至少10 µm, 并在显微镜下观察蜡带以決定取舍。
- 将ddH2O滴加在涂有多聚赖氨酸的载玻片上,把蜡带的反面漂浮其上并放在烫板上展片(展片机提前设置为42°C) 。待蜡带完全展开后,吸去多余的水,在烫板上干燥过夜。
七、染色
- 除蜡:二甲苯(15 min)——二甲苯(15 min)——二甲苯:乙醇(1:1,10 min)——100% ethanol(5 min)——100% ethanol(5 min)——95% ethanol(5 min)——85% ethanol(5 min)——70% ethanol(5 min)——50% ethanol (5 min)——ddH2O(5 min)。

- 苏丹红IV配制。母液stock solution: 0.1% w/v in isopropyl alcohol(0.03 g苏丹红IV + 30 ml异丙醇 );按母液/H2O(3:2,即30 ml stock solution + 20 ml ddH2O)的方式将其稀释为工作液。充分混匀后,室温静置30 min,然后注射器过滤去除沉淀。
- 染色:染液添加到切片上,染色10 min-30 min(根据切片材料调整)。
- 除去多余染液:用50%异丙醇洗一次,ddH2O洗一次,最后加水盖上盖玻片,立即观察拍照。(或者乙醇梯度:70% 1 min——85% 1 min——95% 1 min——100% 2 min——100% 2 min——二甲苯:乙醇(1:1,3 min)——二甲苯 3 min)
- 显微镜观察拍照。
Reference
Girard A-L, Mounet F, Lemaire-Chamley M, Gaillard C, Elmorjani K, Vivancos J, Runavot J-L, Quemener B, Petit J, Germain V, et al. (2012). Tomato GDSL1 Is Required for Cutin Deposition in the Fruit Cuticle. The Plant Cell 24: 3119–3134.